S-2030 : بررسی ساختار باتری های پرکاربرد
Battery Building Blocks
باتریهای لید اسید، نیکل و لیتیوم، پرکاربردترین باتریها در حال حاضر میباشند. ما در این مقاله ساختار باتریها را بررسی کردهایم. برای آشنایی بیشتر با ساختار باتری ها، این مطلب را تا انتها بخوانید.
ساختار باتری الکتروشیمیایی
ساختار باتری الکتروشیمیایی شامل کاتد، آند و الکترولیت است که به عنوان کاتالیزور عمل میکند. هنگام شارژ، تجمع یونهای مثبت در رابط کاتد/الکترولیت ایجاد میشود. این امر باعث حرکت الکترونها به سمت کاتد میشود و پتانسیل ولتاژی بین کاتد و آند ایجاد میکند. با عبور جریان از کاتد (مثبت) از طریق بار خارجی و بازگشت به آند (منفی)، رهاسازی صورت میگیرد. در هنگام شارژ، جریان در جهت دیگر شارش مییابد.
مسیرها در ساختار باتری
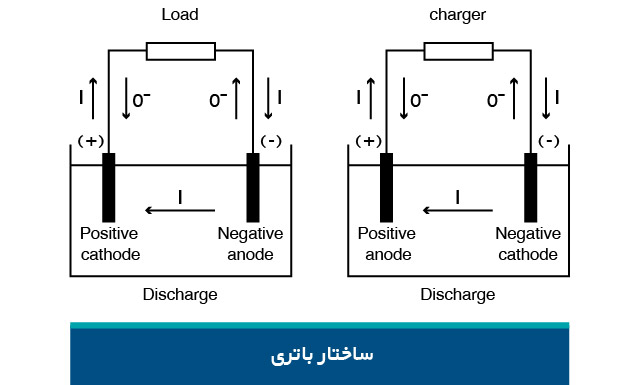
باتری دارای دو مسیر جداگانه است. یکی مدار الکتریکی است که الکترونها از طریق آن جریان مییابند و بار را تغذیه میکنند. دیگری مسیری است که در آن یونها بین الکترودها حرکت میکنند. در این میان، جداکننده به عنوان عایق الکترونها عمل میکند. یونها اتمهایی هستند که الکترونهای خود را از دست داده یا به دست آوردهاند و دارای بار الکتریکی شدهاند. جداکننده، الکترودها را از نظر الکتریکی جدا میکند، اما اجازه حرکت یونها را میدهد.
آند و کاتد
الکترود باتری که در هنگام تخلیه شارژ آزاد میشود، آند نامیده میشود. الکترودی که الکترونها را جذب میکند، کاتد است.
آند باتری، همیشه منفی و کاتد، مثبت است. به نظر میرسد این نحوه مثبت و منفی بودن، قوانین قراردادی را نقض میکند . زیرا آند پایانهای است که جریان در آن برقرار است. لوله خلاء، دیود و یا باتری در حال شارژ از این دستور پیروی میکند. با اینحال، قطع برق باتری در هنگام تخلیه، آند را منفی میکند. از آنجا که باتری یک وسیله ذخیرهسازی الکتریکی برای تامین انرژی است، آند باتری، همیشه منفی است.
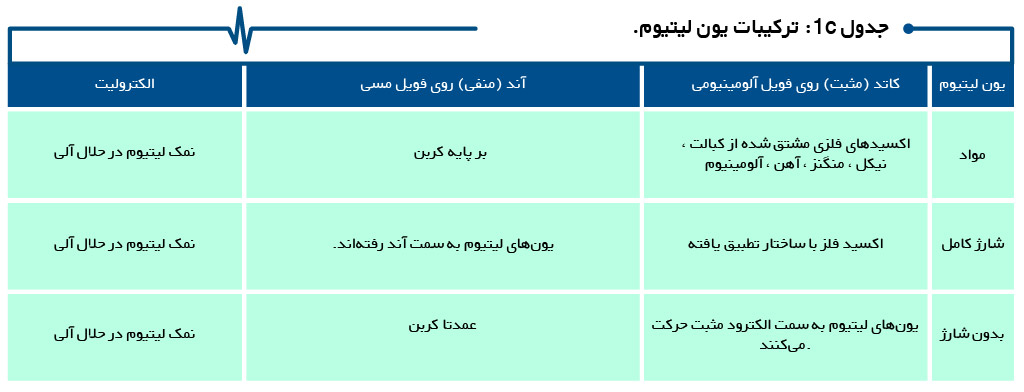
آند یون-لیتیوم، کربن است . اما در ساختار باتری های لیتیوم- فلزی، این ترتیب برعکس میشود. در اینجا، کاتد کربن و آند لیتیوم فلزی است . به استثنای چند مورد، باتریهای لیتیوم-فلزی قابل شارژ نیستند.

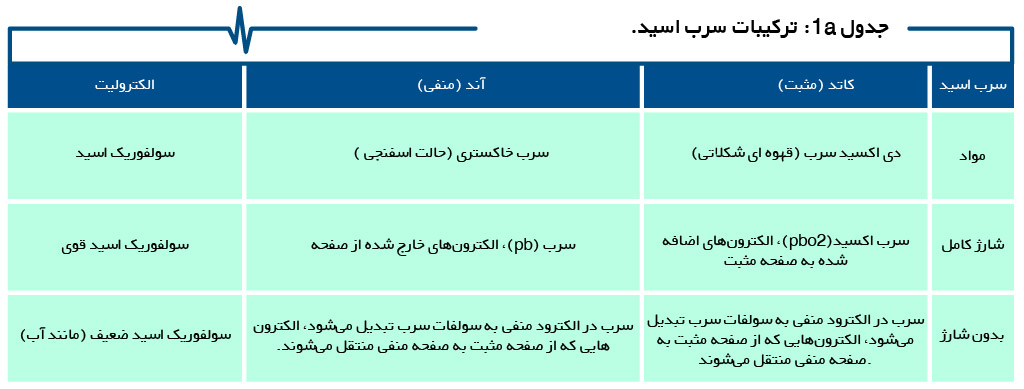
جداول 1a ، 1b ، 1c و 1d ترکیب باتری های ثانویه سرب اسید ، نیکل و یون لیتیوم، از جمله قلیایی اولیه را خلاصه میکند.


الکترولیت و جدا کننده در ساختار باتری
جریان یون با فعال کنندهای به نام الکترولیت، امکانپذیر میشود. در ساختار باتری سرب اسید، الکترولیت آزادانه بین الکترودهای وارد شده حرکت میکند. در یک باتری سیلداسید، معمولاً الکترولیت به صورت مرطوب به جداکننده اضافه میشود. جداکننده، آند را از کاتد جدا میکند و یک جداساز برای الکترونها تشکیل میدهد، اما اجازه عبور یونها را میدهد.
نتیجه گیری
در این مطلب، با ساختار باتری های پرکاربرد، آشنا شدیم. کاربران عزیز، شما میتوانید نکات تکمیلی مدنظرتان را در قسمت نظرات با ما به اشتراک بگذارید.
منابع :
 سایناکو | تولید کننده و وارد کننده باتری و یوپیاس
سایناکو | تولید کننده و وارد کننده باتری و یوپیاس